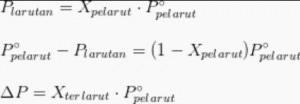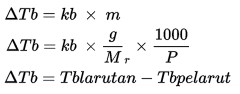Sifat Koligatif Larutan | sekarang ini kami akan membahas mengenai sifat koligatif larutan, yang masih sangkut paut dengan pembahasan menganai zat-zat yang sudah kami bahas sebelumnya seperti zat murni dan juga zat campuran yang memiliki pembahasan cukup banyak, lalu sebenarnya apa itu sifat koligatif larutan itu ??? sifat koligatif itu adlaah sifat-sifat yang hanya bengantung kepada jumlah atau kuantitas sebuah partikel zat yang terlarut didalam larutan, dan tidak bergantung kepada identitas atau jenis partikel zat terlarut, tidak perdulu apapun yang ada didalam zat terlarut itu walaupun berbentuk molekul, ion, ataupun atom, sifat koligatif ini hanya melihat dari sisi kuantitas bukan dari segi kualitas
Sebenarnya sifat larutan itu sama saja seperti kekentalan ( viskositas ), rasa, dan juga warna yang sering kita temui dalam kehidupan sehari-hari, dan contoh simple seperti terasi yang sering digunakan untuk memasak ataupun garam dapur (NaCI) yang cukup mudah untuk ditemui di dapur, apabila anda masih bingung mengenai materi sifat koligatif, sekarang kita menuju ke pembahasan pokok kita agar anda bisa lebih mengerti dan memahami materi kimia mengenai sifat koligatif ini
Sifat Koligatif Larutan
Dibawah ini adalah penjelasan lengkap mengenai sifat koligatif berserta sifat-sifatnya yang sudah kami rangkum agar lebih mudah dimengerti :
Penurunan Tekanan Uap
Apabila zat terlarut itu memiliki sifat non-volatil atau tidak mudah untuk menguap ( tekanan uapnya tidak bisa diukur), maka tekanan uap yang berasal dari larutan itu akan selalu lebih rendah daripada tekanan uap pelarut murni yang volatil, dalam perhitungan ideal seharusnya tekanan uap dari pelarut volatil itu diatas larutan yang memiliki zat terlarut non-volatil berbanding lurus kepada konsenterasi pelarut didalam larutan, sedangkan hubungan yang ada dalam sifat koligatif larutan ini bisa dinyatakan secara kuantitatif didalam hukum Raoult yang berbunyi :
Pº adalah tekanan uap zat cair yang murni
P adalah tekanan uap suatu larutandi tahun 1878 ada seorang ilmuwan dari perancis yaitu Marie Francois Raoult yang melakukan percobaan mengenai tekanan uap jenih larutan, dan dia bisa mendapatkan kesimpulkan kalau tekanan uap jenuh larutan itu sama dengan fraksi nimol pelarut yang dikalikan dengan tekanan uap jenuh pelarut murni, dan kesimpulan ini yang dikenal sebagai hukum Raoult yang sudah kami tulis diatas
Kenaikan Titik Didih
Dan kenaikan titik didih zat cair itu adalah suhu yang tetap disaat zat cair itu mendidih, di titik suhu ini tekanan uap zat cair itu sama dengan suhu dari udara yang ada di sekitarnya, dan hal tersebut mengakibatkan adanya penguapan pada semua bagian dari zat cair, titik didih suatu zat cair itu bisa diukur di tekanan 1 atmosfer, dan dari hasil dari penelitian ternyata titik didih larutan itu memang selalu lebih tinggi jika dibandingkan dari titik didih pelarut murninya, dan hal ini memang disebabkan karena ada partikel-partikel zat terlarut yang ada didalam suatu larutan yang menghalangi adanya penguapan partikel-partikel pelarut, dan karena adanya hal tersebut maka partikel-partikel pelarut itu membutuhkan energi yang jauh lebih besar, kemudian perbedaan dari titik didih larutan itu dengan titik didih pelarut murni itu bisa disebut sebagai kenaikan titik didih yang bisa dinyatakan dengan ΔTb, sedangkan persamaanya juga bisa ditulis sebagai berikut
ΔTb itu sama dengan kenaikan titik didih ( ºC)
kb itu adalah tetapan kenaikan titik didih molal ( ºC kg/mol)
m itu adalah molalitas larutan (mol/kg)
Mr itu adalah molekul relatif
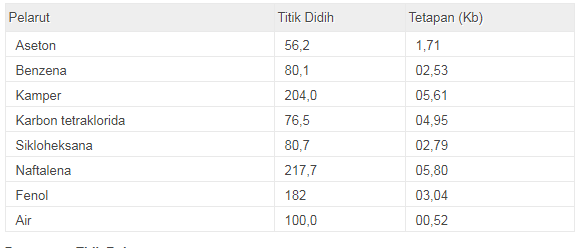
P itu adalah jumlah masa zat (kg)Tabel Kenaikan Titik Didih Dengan beberapa pelarut
Penurunan Titik Beku
Di larutan yang menggunakan pelarut volatil dan zat terlarut non-volatil, itu hanya pertikel-partikel pelarut yang bisa menguap dari larutan yang menyebabkan partikel-partikel dari zat terlarut itu tertinggal, dan hal serupa ini juga terjadi didalam banyak sekali kasus yang ada seperti partikel-partikel pelarut saja yang bisa memadat atau membeku, dan meninggalkan partikel-partikel terlarut yang membentuk larutan yang memiliki konsenterasi lebih pekar, dan titik beku pada suatu larutan itu adalah temperatur dimana tekanan daru uap larutan itu sama dengan uap pelarut murni, di temperatur inidua fasa=berada dalam kesetimbangan-pelarut padat dan larutan cair
Hal ini disebabkan karena terjadinya penurunan tekanan uap dari tekanan uap pelarut, larutan itu membeku di temperatur yang lebih rendah dibandingkan titik beku pelarut murni- titik beku larutan, Tf lebih rendah daripada titik beku learut murni Tf º, dan dengan kata lain jumlah dari partikel-partikel pelarut yang bisa keluar masuk padatan yang membeku persatuan waktu menjadi sama di temperatur yang lebih rendah, dan sifat koligatif larutan itu berupa penurunan dari titik beku ΔTf, yaitu Tf° – Tf yang berbanding lurus pada konsentrasi (molalitas, m) larutan, sebagaimana bisa disebutkan :
dan Kf itu merupakan konstanta penurunan dari titik beku molal (didalam satuan °C/m) sedangkan m itu adalah molalitas dari larutan.
Tekanan Osmotif
Tekanan osmotik itu adalah gaya yang dibutuhkan untuk bisa mengimbangi desakan dari zat pelarut yang melalui selaput semiperniabel yang ada di dalam larutan, membran semipermeabel itu merupakan suatau selaput yang bisa dilalui oleh molekul-molekul pelarut dan tidak bisa dilalui oleh zat terlarut, dan menurut Van’t Hoff tekanan osmotik larutan ini bisa dirumuskan sebagai berikut
IIadalah tekanan osmotik
M adalah molaritas suatua larutan
R adalah tetapan gas (0,082)
Tadalah suhu mutlak
Sifat Koligatif Larutan Elektrolit
Di konsenterasi yang sama, sifat koligatif larutan elektrolit memiliki jumlah nilai yang lebih besar dibandingkan sifat koligatif larutan non elektrolit, dan banyaknya partikel-partikel zat terlarut hasil dari reaksi ionisasi larutan elektrolit ini bisa dirumuskan didalam faktor Van’t Hoff, untuk perhitungan sifat koligatif larutan elektrolit ini selalu menggunakan perkalian faktor van’t hoff sebagai berikut :
i adalah faktor van’t hoff
n adalah jumlah koefisien kation
∝ adalah derajat ionisasi
Dan itulah pembahasan kami saat ini mengenai Sifat Koligatif Larutan semoga informasi yang kami sampaikan dapat dipahami dengan mudah dan bisa menambah wawasan anda dalam materi kimia yang satu ini, anda juga bisa membaca macam-macam pemisah campuran sebagai tambahan referensi anda