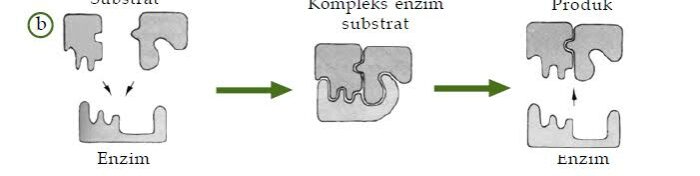
Faktor Yang Mempengaruhi Kerja Enzim – Enzim adalah suatu protein dimana bertindak sebagai katalis serta bertanggung jawab untuk laju dan kekhususan yang tinggi dari satu maupun lebih reaksi biokimia intraselular dan ekstraselular. Enzim bekerja dengan membentuk kompleks enzim substrat, dengan begitu reaksi enzim selalu bolak – balik.

Hampir seluruh enzim ialah protein globular dimana terdiri atas polipeptide tunggal maupun dua atau lebih polipeptide dimana diikat bersama (dalam struktur kuarternari) oleh ikatan non-kovalen. Ini disebabkan oleh konfigurasi tiga dimensi dimana ada dalam larutan, enzim – enzim bertindak terhadap molekul – molekul lain (substrat), serta mengkatalis satu tipe (namun tidak harus satu) reaksi kimia.
1. Suhu / Temperatur
Enzim bersifat termolabil, dimana artinya seluruh aktivitas enzim dipengaruhi oleh suhu. Aktivitas enzim akan terus meningkat sampai dengan batas suhu tertentu, dimana batas suhu tersebut dinamakan suhu optimum.
Seandainya enzim berada di bawah suhu optimum, maka kerja enzim akan terhambat. Enzim pada suhu 0oC maupun di bawahnya bersifat nonaktif, akan tetapi pada suhu tersebut enzim tidak rusak.
Kenaikan suhu bisa meningkatkan akivitas enzim. Namun, saat suhu melebihi batas optimum enzim bisa mengalami denaturasi / kerusakan. Hal tersebut akan mengakibatkan enzim tidak bisa berfungsi sebagai katalis lagi.
Baca Juga : Jaringan Penyokong
Seperti contoh, enzim manusia mempunyai suhu optimum 35oC – 40oC, enzim pada bakteri yang hidup di air panas mempunyai suhu optimum 70oC maupun lebih.
2. Derajat Keasaman / pH
Molekul enzim biasanya ialah protein globular, dimana bentuk dan fungsinya bisa dipengaruhi oleh perubahan pH pada cairan di sekitarnya, enzim mempunyai pH optimum yang bisa bersifat basa maupun asam.
Sebagian besar enzim mempunyai pH optimum antara 6 – 8. Perubahan pH akan mengakibatkan sisi aktif enzim yang berubah keefektifannya didalam membentuk kompleks enzim substrat, sehingga bisa menghalangi terikatnya substrat pada sisi aktif enzim.
Selain itu, perubahan pH juga mengakibatkan proses denaturasi atau kerusakan terhadap enzim. Denaturasi oleh pH yang ekstrim umumnya bersifat bolak – balik, namun tidak bolak – balik pada denaturasi yang terjadi karena suhu panas.
Dengan peningkatan suhu, maka akan meningkatkan laju tumpukan antara enzim dengan molekul substrat, sehingga nanti akan meningkatkan laju pembentukan kompleks enzim substrat dan juga meningkatkan kecepetan reaksinya.
Hal ini bertentangan dengan peningkatan denaturasi enzim terhadap suhu optimum karena reaksi tersebut teralampaui. Akhirnya reaksi itu berhenti, kadang – kadang hanya pada temperatur lebih dari 100oC.
Sebagai contoh, enzim ptialin di mulut hanya bisa bekerja pada pH netral, enzim pepsin di lambung bekerja pada pH asam, sebaliknya enzim tripsin di usus bekerja pada pH basa.
3. Konsentrasi Enzim / Substrat
Semakin besar konsentrasi, maka akan meningkatkan kecepatan reaksi. Peningkatan kecepatan reaksi akan terus bertambah sehingga tercapai kecepatan konstan, yaitu jika seluruh substrat telah terikat oleh enzim. Dengan begitu, konsentrasi enzim berbanding lurus terhadap kecepatan reaksi.
Bertambahnya konsentrasi substrat pada suatu reaksi akan meningkatkan kecepatan reaksi, saat jumlah enzim pada reaksi itu tetap. Tetapi, saat seluruh sisi aktif enzim sedang bekerja, penambahan konsentrasi substrat tidak bisa meningkatkan kecepatan reaksi.
Dengan begitu, akan menunjukkan jika kecepatan reaksi sudah mencapai titik maksimum. Peningkatan kecepatan reaksi akan terus bertambah hingga tercapai kecepatan konstan yaitu jika seluruh enzim mengikat substrat.
Pada tiap saat, proporsi molekul – molekul enzim dimana terikat pada substrat, maka akan tergantung pada konsentrasi substratnya. Karena konsentrasi meningkat, kecepatan awal dari reaksi (Vo) disaat penambahan enzim akan meningkat sampai dengan nilai maksimum, Vmax, pada tingkat substrat, enzim ini dikatakan jenuh (semua sisi aktif maksimum), dan penambahan jumlah substrat tidak akan menaikkan Vo.
Nilai konsentrasi substrat pada saat Vo = ½ Vmax dikenal dengan tetapan MICHAELS (Km) dimana untuk reaksi substrat-enzim. Rendahnya nilai Km akan menunjukkan afinitas tinggi atas enzim untuk substratnya.
Beberapa enzim (seperti contoh aspartase) yang hanya akan mengikat satu molekul substrat dimana begitu khusus dikarenakan enzim yang lain dapat mengikat berbagai substrat lain, khusus untuk enzim tersebut seperti seluruh ikatan peptida terminal pada kasus eksopeptidase.
Perbedaan tersebut muncul atas derajat stereospesifitas enzimnya, dimana banyak yang membutuhkan gugus prostetik menempel maupun koenzim yang dapat melebur untuk melaksanakan kegiatan aktivitasnya. Pada enzim – enzim tersebut komponen proteinnya dikenal sebagai apoenzim dan seluruh kompleks enzim kofaktor fungsional dikenal dengan holoenzim.
4. Zat – Zat Penggiat / Aktivator
Aktivator adalah suatu zat atau molekul, dimana berfungsi untuk memacu maupun mempercepat reaksi enzim. Seperti contoh dari aktivator ialah garam- garam dari logam alkali pada kondisi encer (2% – 5%), serta ion logam seperti Ca, Mg, Ni, Mn, dan Cl. Hal ini juga ialah suatu Faktor yang Mempengaruhi Kerja Enzim.
Baca Juga : Fungsi Sitoplasma
5. Zat – Zat Penghambat / Inhibitor
Inhibitor adalah suatu molekul yang bisa menghambat aktivitas enzim. Zat ini dapat dibedakan menjadi dua macam inhibitor enzim, yaitu inhibitor kompetitif dengan inhibitor nonkompetitif.
Inhibitor Kompetitif
Inhibitor kompetitif (inhibitor irreversible) adalah suatu molekul penghambat kerja enzim dimana bekerja dengan cara bersaing terhadap sisi aktif enzim. Inhibitor kompetitif (inhibitor irreversible) berkaitan dengan secara kuat pada sisi aktif enzim, nah pengikatan ini berlangsung secara bolak – balik sehingga persentase penghambatan untuk tingkat inhibitor yang tetap menjadi berkurang saat substratnya ditambah.
Jadi, inhibitor kompetitif ini bisa dihilangkan dengan cara menambah konsentrasi substrat. Seperti contoh yang begitu penting dari pengikatan ini ialah : dengan melibatkan enzim yang berlimpah, ribulose bifosfat karboksilase, enzim penambat CO2 terhadap C3 fotosintesis dan terhadap proses ini molekul – molekul O2.
Dengan begitu akan bersaing dengan molekul – molekul CO2 dimana untuk sisi aktif serta contoh lainnya adalah sianida dimana terlarut dalam darah bersaing dengan oksigen dimana demi berikatan terhadap sisi aktif hemoglobin.
Inhibitor Nonkompetitif
Inhibitor yang terikat pada sisi alosetrik enzim (atau selain sisi aktif enzim) disebut inhibitor nonkompetitif. Inhibitor nonkompetitif merupakan suatu molekul penghambat kerja enzim dimana bekerja dengan cara melekatkan diri pada luar sisi aktif enzim, yang bisa menyebabkan sisi aktif enzim berubah serta tidak bisa berfungsi lagi.
Sehingga substrat tidak bisa berikatan dengan sisi aktif enzim. Inhibitor ini tidak bisa dihilangkan meskipun dengan menambahkan substrat. Contoh inhibitor nonkompetitif ialah Ag+, Hg2+, dan Pb2+.
Baca Juga : Vegetasi Adalah
Enzim adalah suatu protein dimana bertindak sebagai katalis serta bertanggung jawab untuk laju dan kekhususan yang tinggi dari satu maupun lebih reaksi biokimia intraselular dan ekstraselular
Karena tiap enzim mempunyai sisi aktif dimana sesuai hanya dengan satu jenis substrat, berarti setiap enzim hanya bisa bekerja pada satu substrat dimana yang cocok dengan sisi aktifnya.
Enzim tersusun atas dua bagian, yaitu :
1. Apoenzim
2. Gugus prostetik
Demikianlah pembahasan artikel Faktor Yang Mempengaruhi Kerja Enzim ini, semoga bermanfaat dan menjadi ilmu pengetahuan baru bagi para pembaca.


