Dalam persamaan reaksi kimia berlaku Hukum Lavoisier atau Hukum Kekekalan Massa, dimana menyatakan bahwa “massa sebelum dan sesudah reaksi adalah sama”. Massa zat berbanding lurus dengan jumlah atomnya. Dengan begitu, bisa diartikan jumlah atom sebelum bereaksi sama dengan jumlah atom hasil reaksinya. Supaya memenuhi Hukum Kekekalan Massa, suatu persamaan reaksi harus menyamakan jumlah atom yang digunakan koefisien reaksi. Persamaan reaksi yang jumlah atomnya sudah sama disebut dengan persamaan reaksi sempurna atau persamaan reaksi setara.
Pengertian Persamaan Reaksi Kimia
Persamaan reaksi kimia merupakan pernyataan yang ditulis dengan rumus kimia yang digunakan untuk memberikan informasi identitas dan kuantitas zat-zat yang ada di dalam suatu perubahan kimia ataupun fisika. Semua zat yang berkaitan dalam reaksi yang dimana jumlahnya berkurang usai reaksi disebut pereaksi (reaktan). Hal ini ditempatkan di sebelah kiri tanda panah yang menuju ke arah kanan. Pada sebelah kanan tanda panah ada hasil reaksi (produk), yaitu semua zat yang dihasilkan dari reaksi.
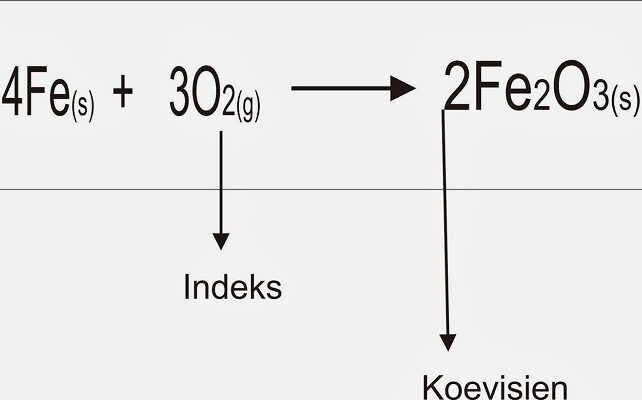
Dalam rumus kimia ada indeks, yakni angka yang ditulis dengan format subscript (berukuran kecil dalam posisi agak ke bawah) di sebelah kanan simbol unsur ataupun kelompok atom unsur (gugus). Indeks ini menyatakan jumlah atom unsur ataupun kelompok atom unsur. Dalam persamaan reaksi dikenal dengan koefisien reaksi, yakni bilangan yang ada di sebelah kiri rumus kimia. Bilangan ini untuk mengalikan jumlah semua atom dalam rumus kimia tersebut.
Penulisan Persamaan Reaksi
Dalam menuliskan persamaan reaksi, ada beberapa langkah yang perlu anda ikuti. Adapun langkah-langkah penulisan persamaan reaksi tersebut ialah sebagai berikut.
- Menuliskan persamaan dalam kata-kata yang didalamnya terdiri dari nama serta wujud zat dari semua pereaksi lengkap dengan hasil reaksi.
- Menerjemahkan persamaan kata-kata ke persamaan rumus kimia dari tiap zat beserta keterangan wujudnya.
- Menyetarakan persamaan dengan cara memberi koefisien yang sesuai.
Cara Menyetarakan Persamaan Reaksi
Suatu reaksi kimia sudah dikatakan setara atau sempurna jika memenuhi beberapa syarat. Adapun syarat tersebut ialah sebagai berikut.
- Jenis unsur-unsur sebelum serta sesudah reaksi selalu sama.
- Sebelum dan sesudah reaksi, jumlah tiap atom selalu sama.
- Perbandingan koefisien reaksi mengatakan perbandingan mol (khusus yang berupa gas perbandingan koefisien juga mengatakan perbandingan volume asalkan suhu serta tekanannya sama).
- Pereaksi serta hasil reaksi dinyatakan dengan rumus kimia secara benar.
- Wujud zat-zat yang ada pada reaksi harus dinyatakan dengan tanda kurung setelah rumus kimia.
Sementara untuk persamaan reaksi yang belum sempurna, anda perlu menyetarakannya. Dalam hal ini, ada juga 2 cara yang bisa anda pilih, yakni cara langsung dan cara tidak langsung. Tiap cara tersebut memiliki keunggulan dan tingkat kesulitan yang berbeda-beda. Langsung saja, berikut ulasan lengkapnya untuk anda.
Cara Langsung
Cara langsung dilakukan dengan melihat persamaan reaksi. Setelah itu, jumlah atomnya langsung disamakan secara coba-coba. Cara yang satu ini disebut juga dengan cara menebak. Pada umumnya, cara ini digunakan untuk persamaan reaksi yang sederhana. Akan tetapi, jika anda sudah terbiasa, persamaan reaksi yang kompleks pun bisa anda selesaikan dengan cara ini.
Cara Tidak Langsung
Cara tidak langsung merupakan cara menyetarakan persamaan reaksi kimia dengan menggunakan persamaan matematika. Hal ini disebut juga dengan cara permisalan. Penyetaraan reaksi memang bisa dilakukan dengan cara yang lebih sistematis, yakni dengan menyusun serta menyelesaikan persamaan matematis.