Dalam rumus kimia, kita tak hanya mengenal rumus molekul saja, melainkan juga rumus empiris. Rumus ini adalah rumus kimia yang mengatakan rasio perbandingan terkecil dari atom-atom yang membentuk sebuah senyawa. Dalam kimia, rumusan empiris atau komposisi kimia dari suatu senyawa kimia ialah ekspresi sederhana jumlah relatif tiap jenis atom (unsur kimia) yang ada di dalamnya. Suatu formula empiris tak memberikan gambaran tentang isomer, struktur, atau jumlah absolut atom.
Istilah empiris sebenarnya merujuk pada proses analisis elemental, yakni suatu teknik kimia analitik yang dipakai untuk menentukan persentasi komposisi relatif per unsur dari suatu zat kimia. Menurut sejarah, rumusan empiris ditentukan melalui penggabungan nisbah bobot dari unsur-unsurnya. Hal ini adalah langkah yang penting untuk memperlihatkan sifat berkala dari unsur-unsurnya. Untuk info lebih jelasnya, anda simak saja ulasan lengkap mengenai rumus empiris berikut ini.
Rumus Empiris
Percobaan rumus empiris sebenarnya juga bisa dilakukan untuk menentukan daya gabung suatu unsur. Belakangan ini, unsur sintetik lawrensium diketahui mempunyai daya gabung tiga. Hal ini berdasarkan percobaan rumus empiris lawrensium radio aktif gabung dengan klorin menghasilkan lawrensium klorida dengan rumus CrCl3. Perlu dipahami, semua latihan mengenai penentuan rumus empiris umumnya ditentukan dari banyaknya masing-masing unsur yang ada pada senyawa yang dinyatakan sebagai persen massa atau massa. Dari inilah kita bisa menghitung rumus empiris suatu molekul.
Rumus empiris bisa ditentukan dari data sebagai berikut.
- Macam unsur dalam senyawa (analisis kualitataif).
- Persentase komposisi unsur (analisis kuantitaif).
- Massa atom relatif unsur-unsur yang bersangkutan.
Lain halnya untuk tahapan dalam menentukan rumus empiris suatu senyawa ialah sebagai berikut.
- Penentuan massa tiap unsur dalam beberapa massa senyawa tertentu.
- Membagi massa setiap unsur dengan massa atom relatifnya. Dengan begitu, diperoleh perbandingan mol setiap unsur.
- Menyederhanakan perbandingan rumus molekul suatu zat. Rumus molekul ini adalah kelipatan bilangan bulat dari rumus empiris. Sementara untuk menentukan rumus molekul suatu zat, anda harus menentukan bobot molekul disamping rumus empiris.
Contoh Soal Rumus Empiris
Untuk membantu anda memahami rumus empiris, berikut kami bagikan contoh soal rumus empiris lengkap dengan pembahasannya selengkapnya. Anda bisa cermati setiap langkahnya.
Soal
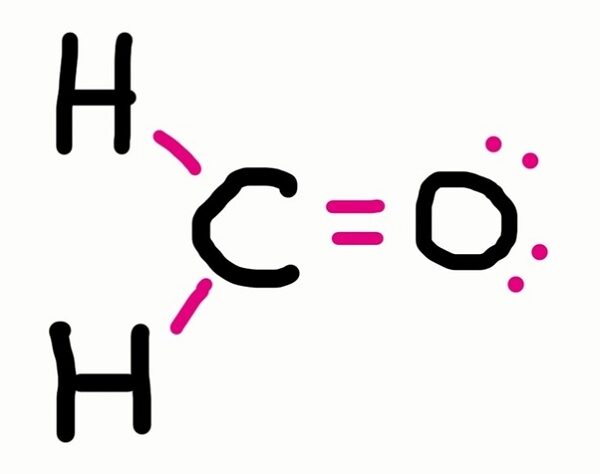
Suatu senyawa diketahui mengandung unsur karbon, hidrogen, dan oksigen. Tiap unsur tersebut memiliki persentase 41,82% untuk atom C, 6,51% untuk atom H, serta 51,67% untuk atom O. Setelah mengetahui datanya, maka tentukan rumus empiris senyawa tersebut?
Pembahasan:
Diketahui bahwa suatu senyawa memiliki kandungan unsur C, H, dan O, dengan persentase 41,82%, 6,51% dan 51,67%. Andaikan massa cuplikan senyawa tersebut sebesar 100 gram, maka massa unsurnya ialah:
C = 41,82 gram
H = 6,51 gram
O = 51,67 gram
Dikarenakan perbandingan jumlah mol juga menyatakan perbandingan jumlah partikel atau perbandingan jumlah atom, maka perbandingan jumlah mol bisa anda gunakan untuk menentukan rumus empiris. Untuk jumlah mol masing-masing unsur ialah:
mol C : mol H : mol O
= atom C banding atom H banding atom O
= 3,485 : 6,510 : 3,229
Dikarenakan atom-atom dalam molekul adalah kelipatan bilangan bulat, maka perbandingan jumlah atom tersebut harus merupakan bilangan bulat serta sederhana. Hal ini bisa dilakukan dengan membagi ketiga bilangan tersebut dengan kelipatan paling kecil, yakni 3,229, maka diperoleh angka banding sebagai berikut.
1,08 : 2,02 : 1,00
Perbedaan angka di belakang koma pada desimal bisa diabaikan. Dengan begitu, perbandingan atom C, H, dan O ialah 1 : 2 : 1.
Jadi, rumus empiris senyawa yang dianalisis adalah CH2O.