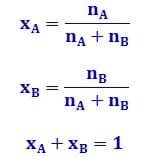Rumusrumus.com kali ini akan membahas tentang rumus Molaritas larutan, Molalitas larutan, Jumlah mol, Normalitas larutan dan Fraksi mol dan disertai dengan cara menghitungnya. Untuk lebih lengkapnya simak penjelasan dibawah ini
Molaritas Larutan (M)
Molaritas yaitu besaran yang menyatakan jumlah mol zat terlarut pada tiap satuan volume larutan.
Satuan molaritas ialah molar (M) yang sama dengan mol/liter. Jika terdapat n mol senyawa terlarut dalam V liter larutan, maka rumus molaritas larutan yaitu :
M = n/V
Keterangan:
M = molaritas suatu zat (mol/L)
V = volume larutan (ml)
gr = massa suatu zat (gram)
Mr = massa molekul relatif suatu zat (gr/mol)
Jumlah Mol Suatu Senyawa
Pada ilmu kimia, banyaknya suatu zat atau senyawa seringkali dinyatakan pada besaran mol. Besaran konsentrasi molaritas, molalitas, normalitas, dan fraksi mol memakai satuan kuantitas zat atau senyawa dalam mol. Mol yaitu gram zat dibagi dengan massa molekul relatif (Mr). Rumus menghitung mol suatu senyawa yaitu :
n = gram/Mr
Keterangan:
n = mol suatu zat (mol)
Mr = massa molekul relatif suatu zat (gram/mol)
gr = massa suatu zat (gr)
Molalitas Larutan (m)
Molalitas yaitu besaran yang menyatakan jumlah mol zat terlarut pada tiap satuan berat pelarut. Satuan molalitas ialah molal (m) yang sama dengan mol/kilogram. Jika n mol senyawa dilarutkan dalam P kilogram pelarut, maka rumus molalitas larutan yaitu :
m = n/p
Keterangan:
m = molalitas suatu zat (molal)
p = massa pelarut (gr)
n = mol suatu zat (mol)
Normalitas Larutan (N)
Normalitas yaitu besaran yang menyatakan jumlah mol ekivalen zat terlarut pada tiap satuan volume larutan. Satuan normalitas ialah normal (N) yang sama dengan mol ekivalen/liter. Rumus normalitas larutan adalah
N = ek/V
atau N = n x a /V
atau N = M x a
Keterangan:
N = normalitas ( mol ek/L)
V = volume larutan (liter)
n = mol suatu zat (mol)
a = ekivalen suatu zat
ek adalah mol ekivalen yaitu jumlah mol dikali jumlah ion H+ atau ion OH–
Jika n mol zat terlarut mengandung sebanyak a ion H+ atau OH–, maka rumus mol ekivalen (ek) ialah :
Ek = n x a
Untuk asam, 1 mol ekivalen sebanding dengan 1 mol ion H+
Untuk basa, 1 mol ekivalen sebanding dengan 1 mol ion OH–
Fraksi Mol Larutan
Fraksi mol yaitu perbandingan jumlah mol suatu komponen larutan dengan jumlah mol keseluruhan komponen larutan. Karena fraksi mol adalah perbandingan mol, maka fraksi mol tidak mempunyai satuan. Jika suatu larutan terdiri dari komponen A dan B dengan jumlah mol nA dan nB, maka rumus fraksi mol A (xA) dan fraksi mol B (xB)
Perbedaan Molalitas dan Molaritas
Molaritas (M) ailah banyaknya mol zat terlarut dalam 1 liter larutan, sedangkan
Molalitas (m) ialah banyaknya mol zat terlarut dalam 1kg pelarut.
Moralitas ( M ) yaitu satuan konsentrasi yang banyak dipakai dan didefinisikan sebagai banyak mol zat terlarut dalam 1 liter larutan dalam satuan M. Sedangkan
Molalitas ( m ) yaitu satuan konsentrasi yang menyatakan jumlah mol zat yang terdapat pada 1 kg pelarut dengan satuan mol
Contoh Soal
Contoh perhitungan mol
menghitung jumlah mol dari 10 gram garam dapur (NaCl) yang diketahui mempunyai massa relatif molekul 58,5.
Jumlah mol , n = gram/Mr = 10/58,5 = 0,171 mol.
jumlah mol 10 gram garam dapur yaitu 0,171 mol
Contoh perhitungan molaritas larutan
Misalnya 0,25 liter larutan urea (CO(NH2)2) dibuat dengan cara melarutkan 3 gram urea dalam air.
Massa molekul relatif urea adalah 60.
Molaritas larutan urea bisa dihitung dengan cara :
Jumlah mol urea, n = gram/Mr = 3/60 = 0,05 mol
Molaritas larutan, M = n/V = 0,05/0,25 = 0,2 molar
Maka molaritas larutan urea yaitu 0,2 molar atau 0,2 mol/liter.
Contoh perhitungan molalitas larutan
Misalnya 10 gram natrium hidroksida (NaOH) dilarutkan dalam 2 kg air.
Massa molekul relatif NaOH yaitu 40.
Molalitas larutan bisa dihitung dengan cara :
Jumlah mol NaOH, n = gram/Mr = 10/40 = 0,25 mol
Molalitas larutan, m = n/P = 0,25/2 = 0,125 molal
Maka molalitas larutan NaOH yaitu 0,125 molal
Contoh perhitungan normalitas larutan.
Misalnya 0,5 liter larutan NaOH dibuat dengan cara melarutkan 5 gram NaOH (Mr = 40) dalam air.
Normalitas larutan bisa dihitung dengan cara :
Mol NaOH, n = gram/Mr = 5/40 = 0,125 mol
Jumlah ion OH–, a = 1
Mol ekivalen, ek = n x a = 0,125 x 1 = 0,125
Normalitas, N = ek/V = 0,125/0,5 = 0,25 N
Maka normalitas larutan ialah 0,25 N
Contoh perhitungan fraksi mol
Misalkan suatu larutan yang dibuat dari 5,85 gram garam dapur (Mr = 58,5) yang dilarutkan dalam 90 gram air (Mr = 18).
Maka fraksi mol garam dapur dan fraksi mol air bisa dihitung dengan cara :
Mol garam dapur, nG = 5,85/58,5 =0,1 mol
Mol air, nA = 90/18 = 5 mol
Fraksi mol garam dapur, xG = nG/(nG+nA) = 0,1/(0,1+5) = 0,0196
Fraksi mol air, xA = nA/(nG+nA) = 5/(0,1+5) = 0,0196 = 0,9804
demikianlah penjelasan tentan Mol, Semoga bermanfaat
Artikel Terkait :