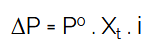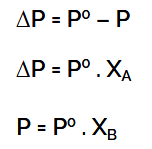Rumusrumus.com kali ini akan membahas tentang sifat rumus koligatif larutan, juga akan menjelaskan pengertian tentang sifat koligatif larutan beserta keterangan nya
Pengertian
Sifat koligatif
Sifat koligatif ialah sifat-sifat fisik larutan yang bergantung kepada konsentrasi partikel zat terlarut, akan tetapi tidak pada jenisnya. Larutan elektrolit memiliki sifat koligatif yang lebih besar dari pada larutan non elektrolit berkonsentrasi sama dikarenakan larutan elektrolit memiliki jumlah partikel terlarut yang lebih banyak.
Tekanan Uap Larutan
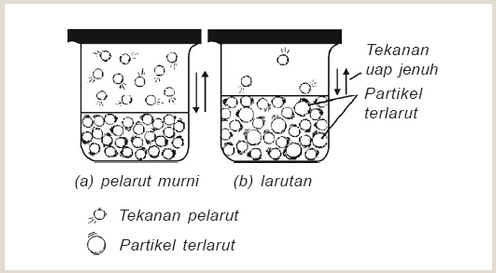
Tekanan uap suatu zat alah tekanan yang ditimbulkan pada uap jenuh zat itu. Semakin tinggi suhunya, semakin besar juga tekanan uap nya. andai zat terlarut tidak menguap maka tekanan uap larutan menjadi lebih rendah dari tekanan uap pelarutnya. Selisih antara uap pelarut murni dengan tekanan uap larutan disebut penurunan tekanan uap larutan
ΔP = P0 – P
Menurut Roulth, jika zat terlarut tak menguap, maka penurunan tekanan uap larutan sebanding dengan fraksi mol terlarut, sedang tekanan uap larutan sebanding dengan fraksi mol pelarut.
P = Xpel x P0
ΔP = Xter x P0
Zat terlarut menurunkan tekanan uap pelarut.
Rumus sifat koligatif larutan mempunyai delapan rumus yang terbagi menjadi empat rumus sifat koligatif larutan non elektrolit dan empat rumus sifat koligatif larutan elektrolit.
Rumus Sifat Koligatif Larutan Elektrolit
1. ΔP (penurunan tekanan uap jenuh)
keterangan :
- ΔP = tekanan uap jenuh
- P° = tekanan uap pelarut murni
- X† = fraksi mol zat pelarut
- i = faktor van’t hoff
2. Kenaikan Titik Didih
keterangan :
- ΔTb = kenaikan titik didih
- Kb = ketetapan kenaikan titik didih
- m = molalitas larutan
- i = faktor van’t hoff
3. Penurunan Titik Beku
keterangan :
- ΔTf = penurunan titik beku
- Kf = tetapan penurunan titik beku
- m = molalitas larutan
- i = faktor van’t hoff
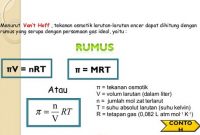
4. Tekanan Osmosis Larutan
keterangan :
- ∏ = tekanan osmosis larutan
- M = molaritas
- R = tetapan gas
- T = suhu mutlak
- i = faktor van’t hoff
Rumus Sifat Koligatif Larutan Non Elektrolit
1 . Penurunan Tekanan Uap Jenuh
- ΔP = penurunan tekanan uap jenuh
- P° = tekanan uap pelarut murni
- XA = fraksi mol zat pelarut
- XB = fraksi mol pelarut
2. Kenaikan Titik Didih
keterangan :
- ΔTb = kenaikan titik didih
- Kb = ketetapan kenaikan titik didih
- m = molalitas larutan
3. Penurunan Titik Beku
keterangan :
- ΔTf = penurunan titik beku
- Kf = tetapan penurunan titik beku
- m = molalitas
4. Tekanan Osmosis
keterangan :
- ∏ = tekanan osmosis larutan
- M = molaritas
- R = tetapan gas
- T = suhu mutlak
Kesimpulan :
Penurunan titik beku secara umum mempunyai konsep yang sama dengan kenaikan titik didih. Larutan yang memiliki titik beku yang cenderung rendah dari pelarutnya. Makin tinggi konsentrasi zat terlarut nya, makin rendah titik beku larutan nya. Penurunan titik beku larutan bisa di cari dengan rumus ΔTf = m x Kf, dimana ΔTf ialah penurunan titik beku, m adalah molalitas larutan, dan Kf adalah tetapan penurunan titik beku molalitas.
Kenaikan titik didih larutan selalu mempunyai nilai yang lebih tinggi dari titik didih pelarut murni nya. Hal ini disebabkan karena partikel di dalam zat terlarut dalam larutan mencegah peristiwa penguapan partikel-partikel pelarut. Kenaikan titik didih bisa di ukur dengan rumus ΔTb = m.Kb, dimana ΔTb adalah kenaikan titik didih, Kb adalah tetapan kenaikan titik didih, dan m adalah molalitas.
Baca Juga :