Aturan Bilangan Oksidasi – Langsung saja didalam Pengertian Bilangan Oksidasi didalam ilmu Kimia adalah suatu bilangan yg menunjukkan suatu ukuran kemampuan atas suatu Atom yang nantinya akan melepas dan menangkap suatu Elektron didalam pembentukkan suatu senyawa. Namun Definisi Bilangan Oksidasi yang lainnya mempunyai artian suatu jumlah muatan yg mempunyai Atom didalam Suatu Unsur jika telah bergabung dg Unsur Atom yang lainnya.
Dan tidak bisa dipungkiri bahwa Pengaturan Bilangan Oksidasi ini cukup sering muncul didalam Soal – Soal Ujian, baik Soal Ujian Akhir Sekolah (UAS) dan Ujian Nasional (UN) ditingkat Sekolah Menengah Atas (SMA) sehingga sangat disarankan sekali bagi kalian Para Pembaca di laman Rumus Rumus, yang khususnya Pelajar tingkat Sekolah Menengah Atas (SMA) untuk belajar lebih memahami tentang Bilangan Oksidasi didalam Pelajaran Kimia SMA (Sekolah Menengah Atas).
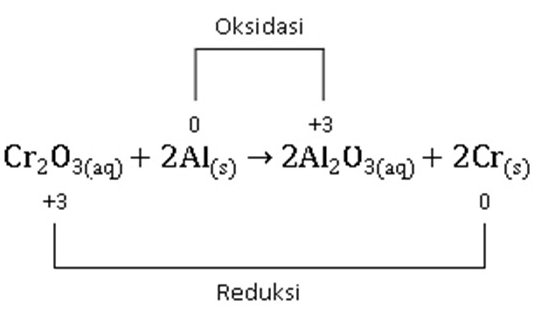
Sebagai contohnya jika terdapat Soal Ujian Sekolah dan Ujian Nasional seperti ini : ‘ dari manakah bilangan oksidasi +2, +1, -3 ini ditemukan ? ‘ . Jika terdapat Soal Ujian yang seperti itu, jika kalian telah memahami dan mengetahui Peraturan Bilangan Oksidasi didalam Kimia maka sudah tentu kalian bisa mengerjakan Soal tersebut dengan mudah dan benar. Hal tersebut dikarenakan dlm menemukan bilangan oksidasi itu terdapat aturannya sendiri, tidak boleh asal sehingga dibawah ini telah Penulis buatkan kepada kalian Para Pembaca tentang Aturan Mencari Bilangan Oksidasi secara lebih lengkap.
7 Aturan Bilangan Oksidasi Secara Lengkap
Setelah kalian cukup memahami tentang Bilangan Oksidasi Kimia secara lebih sederhana diatas, maka bisa kalian pahami tentang Tujuh Aturan Bilangan Oksidasi yang telah dituliskan secara lebih lengkap dan lebih rinci dibawah ini :
1. Atom didalam unsur bebas atau senyawa unsur memiliki Bilangan Oksidasi 0 (Nol). Misalnya jika O2, N2, H2, Na, Fe, C12 dan senyawa bebas yang tidak berikatan atau berikatan dg Atom sejenis membentuk Unsur Senyawa.
2. Atom O dlm Senyawa memiliki Bilangan Oksidasi -2 kecuali pd Senyawa F2O, Atom O mempunyai Bilangan Oksidasi +2, pada Peroksida O mempunyai Biloks -1. Contoh Senyawa Peroksida seperti Natrium Peroksida (Na202), Hidrogen Peroksida (H202), Barium Peroksida (Ba02). Pada Senyawa Super Oksida Atom O mempunyai Bilangan Oksidasi -0,5.
3. Atom H dlm senyawa umumnya mempunyai Biloks +1 dan hal ini tidak berlaku pada Senyawa Hidrida (Senyawa Hidrogen Logam). Hidrogen pada Senyawa Hidrida (Senyawa Hidrogen Logam) memiliki Bilangan Oksidasi -1. Contohnya Atom H mempunyai Biloks +1 di Senyawa HCI, HBr, HNO3 dan H2SO4.
4. Aturan Bilangan Oksidasi Yang Keempat adalah Atom Logam dlm Senyawa mempunyai Bilangan Oksidasi sesuai dg jumlah elektron valensi dari Atom Logam tersebut. Seperti contohnya jika Unsur Logam dlm Golongan IA seperti Na dan K mempunyai Biloks +1, gol llA seperti Be, Mg dan Ca mempunyai Biloks +2.
5. Peraturan Bilangan Oksidasi Yang Kelima adalah Bilangan Oksidasi Unsur didalam Suatu Ion Tunggal sama dg muatannya. Dan yang dimaksud dg ion Tunggal adalah Ion yg terdiri dari satu buah Atom seperti Cu2+, nah bilangan Oksidasi dari Ion Tunggal tersebut sama dg Muatannya.
6. Yang Keenam adalah Jumlah Bilangan Oksidasi pada Senyawa Netral yang sama dengan 0 (Nol). Sebagai contohnya jika kalian melihat Senyawa H2SO4, Biloks H = +1, O = -2, dan S = + 6 —> 2 x (+1) + 6 – 4 (-2) = O.
7. Untuk Aturan Bilangan Oksidasi Yang Ketujuh atau yang terakhir adalah Jumlah Total dari Bilangan Oksidasi suatu Senyawa Ion yang sama dg muatan dari Senyawa Ion tersebut.
Contoh Soal Bilangan Oksidasi Lengkap
Langsung saja untuk Contol Soal didalam Bilangan Oksidasi, bahwa didalam ‘ Berapakan nilai Biloks dari Atom C didalam Bilangan Oksidasi pada CH4 dengan Aturan Bilangan Oksidasi Biloks H = +1 ?
Jawaban :
Biloks H x Jumlah Atom H = + ‘1 x 4 = +4
Biloks C x Jumlah Atom C = a x 1 = a
Jika dilihat dari Senyawa tersebut ialah Senyawa Netral, maka Jumlah Biloks dari Unsur Unsur didalamnya haruslah NOl, berarti :
a + (+4) = O
a = -4
Jadi Bilangan Oksidasi C pada Senyawa CH4 adalah -4.
Demikianlah pembahasan tentang Aturan Bilangan Oksidasi dan Contoh Soalnya didalam Mata Pelajaran Kimia, dan semoga saja ulasan ini bisa berguna serta bermanfaat bagi kalian Para Pembaca khususnya Para Pelajar tingkat Sekolah Menengah Atas (SMA) yang ada di Tanah Air. Kemudian sebagai tambahan informasi saja bahwa jika kalian ingin mengetahui pembahasan yang lain seperti Sifat dan Teori Asam Basa didalam Ilmu Kimia maka kalian bisa langsung menuju tautan tersebut, karena ditautan tersebut telah dibahas secara lebih detail dan lebih lengkap tentang Teori Asam Basa.