Etanol sering disebut juga etil alkohol, alkohol absolut, alkohol murni, atau alkohol saja. Etanol merupakan sejenis cairan yang mudah menguap, tak berwarna, mudah terbakar, dan termasuk jenis alkohol yang paling sering digunakan dalam kehidupan sehari-hari. Senyawa yang satu ini merupakan obat psikoaktif dan bisa ditemukan pada minuman beralkohol serta termometer modern. Etanol termasuk salah satu obat rekreasi yang paling tua. Lebih lanjut, kami akan bagikan mengenai rumus kimia etanol lengkap dengan info menarik lainnya.
Rumus Kimia Etanol
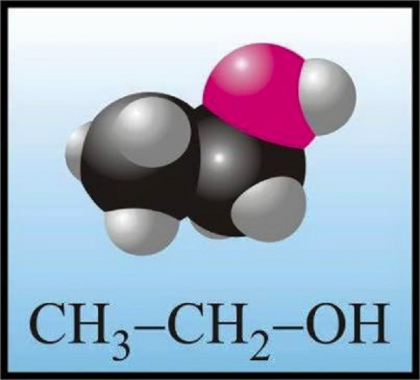
Etanol adalah senyawa alkohol dengan dua rantai karbon, (C2), dan satu gugus hidroksil (OH). Rumus kimia etanol ialah C2H5OH atau yang sering juga ditulis dengan C2H6O atau CH3CH2OH. Gugus -OH adalah gugus fungsi, yakni bagian yang menentukan sifat alkohol. Reaksi kimia pun cenderung terjadi pada gugus fungsi. Hanya saja, kecuali beberapa reaksi misalnya reaksi pembakaran. Rantai alkil, R, dalam hal ini C2H5-, memiliki sifat kurang reaktif. Sifat kimia etanol, diantaranya reaksi pembakaran, reaksi dengan logam alkali, dan asam karboksilat.
Reaksi Etanol
Berikut adalah beberapa reaksi etanol selengkapnya untuk anda.
- Reaksi pembakaran
CH3CH2OH + O2 → CO2 + H2O
Etanol bisa digunakan sebagai bahan bakar. Spiritus adalah etanol yang sudah dicampur dengan metanol supaya tidak disalah-gunakan. Warna ungu tersebut merupakan zat warna untuk membedakan etanol sebagai bahan bakar dan etanol untuk keperluan lain. Metanol ialah racun, bisa menyebabkan mata menjadi buta. Reaksi pembakaran etanol yang sempurna akan membentuk gas CO2 dan uap air.
- Reaksi etanol dengan logam alkali
CH3-CH2-OH + Na → CH3-CH2-ONa + H2
Mula-mula etanol dicampur bersama kristal CaCl2 supaya kandungan air dalam etanol bisa diserap oleh CaCl2. Setelah itu, etanol tanpa air tersebut direaksikan dengan logam natrium, Na, membentuk natrium etanolat serta gas hidrogen. Adapun alasan etanol dibebaskan lebih dahulu dari air ialah karena air bereaksi dengan Na dan sangat eksoterm. Energi atau mungkin api yang dibentuk bisa membakar etanol sehingga kemungkinan akan menimbulkan ledakan.
- Reaksi etanol dengan asam etanoat
CH3-CH2-OH + CH3-COOH ↔ CH3COOCH2CH3 + H2O
Reaksi ini dinamakan dengan reaksi esterifikasi. Pada reaksi ini dibutuhkan asam sulfat pekat sebagai dehidrator, yakni menarik air yang dihasilkan. Reaksi ini termasuk reaksi reversible (kesetimbangan). Dengan adanya asam sulfat, maka letak kesetimbangan akan bergeser. Dengan begitu, ester yang dihasilkan cukup banyak.
Penggunaan Etanol
Di bawah ini adalah beberapa penggunaan etanol dalam kehidupan sehari-hari.
- Pembersih Luka dan Peralatan Medis
Etanol mempunyai sifat sebagai antiseptik yang berarti bisa membunuh bakteri, jamur, dan mikroorganisme. Sifat yang satu ini memungkinkan penggunaannya untuk membersihkan luka. Dengan begitu, bakteri berbahaya akan mati dan tak menyebabkan luka yang lebih parah. Peralatan medis, khususnya pada proses operasi membutuhkan bahan sanitasi yang ampuh untuk membersihkannya. Etanol ini pun memiliki peran utama dalam hal tersebut.
- Bahan Pelarut
Salah satu sifat etanol yang tidak kalah penting ialah bisa melarutkan beragam jenis zat. Sifat yang satu ini serupa dengan pelarut air serta membuat etanol digunakan sebagai pelarut universal untuk berbagai campuran. Baik itu di dunia industri maupun di laboraturium.
- Minuman Keras
Rumus kimia etanol juga memungkinkan penggunaannya sebagai minuman keras. Etanol adalah produk utama dalam proses fermentasi gula. Hal ini berarti semua minuman beralkohol yang diproduksi melalui proses fermentasi adalah campuran etanol dan senyawa lain (biasanya gula dan air).